| JEM:发现新型TH9细胞抗肿瘤免疫调控新机制 | ||||||||||||||||||||||
| [ 来源:转载自网络 发布日期:2021-05-11 09:42:20 责任编辑: 浏览次 ] | ||||||||||||||||||||||
|
肿瘤免疫治疗作为一种新兴的肿瘤治疗手段,已成为目前全球肿瘤临床治疗与研究中最具前景的方向之一,特别在面临患者肿瘤复发、化疗药物耐受、肿瘤无法手术切除等临床问题时能提供新的有效策略。
近年来,PD-1/PD-L1免疫检查点阻断疗法已被运用于多种肿瘤的治疗中,可通过增强机体的抗肿瘤免疫反应来发挥功能。然而,这种疗法只对一小部分病人有效,因此研究机体对该疗法不敏感的机制是改善免疫检查点治疗肿瘤的效果和开发相关新药物的关键。TGF-β作为一种免疫抑制因子,已被报道在多种肿瘤组织中表现为高表达,并能介导肿瘤免疫逃逸的发生,阻断TGF-β可大大增强免疫检查点疗法的治疗效果。然而,肿瘤患者体内高水平的TGF-β介导免疫逃逸发生的具体机制仍不清楚。
2021年4月29日,中国科学院上海营养与健康研究所肖意传研究员、江苏省肿瘤医院戴东方副主任医师、上海市胸科医院罗清泉主任医师、浙江大学附属邵逸夫医院温珍珍研究员作为共同通讯作者,在 Journal of Experimental Medicine 期刊在线发表了题为:BFAR coordinates TGFβ signaling to modulate Th9-mediated cancer immunotherapy 的研究论文。
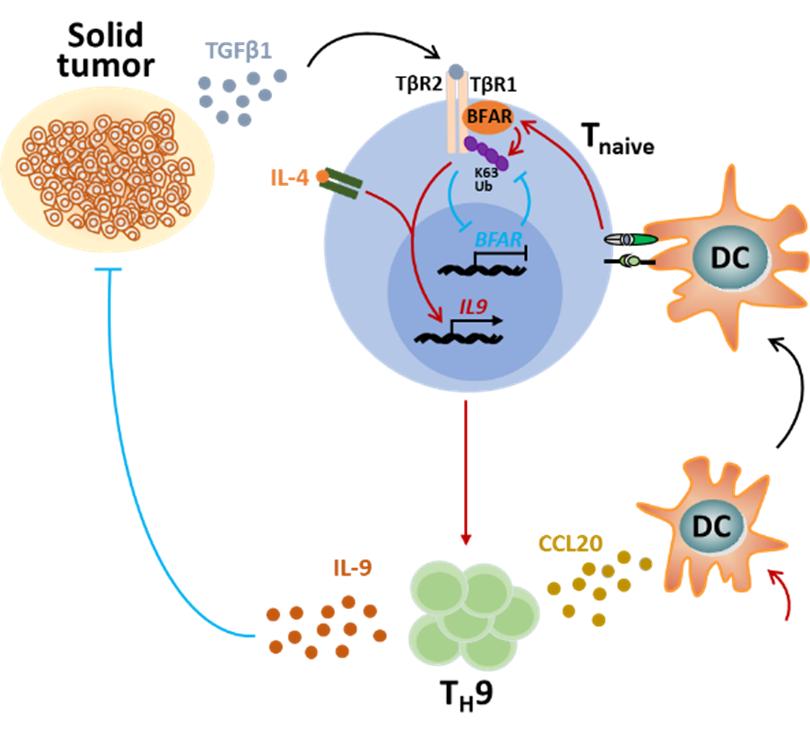
该研究发现,肿瘤来源的TGF-β能够负调控CD4+T细胞中BFAR基因的表达,进而抑制TH9分化及其介导的肿瘤免疫治疗效果,并揭示下游具体的分子调控机制,为增强TH9介导的肿瘤免疫疗法的治疗效果提供了新的策略。
TH9细胞是一类具有显著抗实体肿瘤作用的CD4+T细胞亚群,其不仅可以高效的杀伤并清除实体肿瘤,而且还能有效的抑制肿瘤的转移和复发。
众所周知,TGF-β能够参与诱导TH9细胞的产生,那么,TGF-β是否也能通过促进体内TH9细胞的产生而发挥抗肿瘤的作用?
与预期相反的是,该研究发现,结直肠癌和胃癌病人外周血中的TGF-β水平与TH9特征性细胞因子IL-9的浓度呈负相关性,其原因是肿瘤病人血浆中相对较高浓度的TGF-β会抑制CD4+T细胞中BFAR基因的表达,并通过这种负反馈调节作用抑制TGF-β信号通路的活化和CD4+T细胞向TH9细胞的分化,进而减弱机体的抗肿瘤免疫反应。
进一步的机制研究发现,BFAR能够介导TGF-βR1第268位赖氨酸发生K63连接的泛素化,而这一过程对于维持TGF-β信号通路的活性至关重要。因此BFAR基因的缺失或者TGF-βR1第268位赖氨酸位点的突变会导致TG-FβR1的泛素化修饰受到抑制,进而阻止TGF-β信号通路的激活和TH9细胞的分化。
该研究随后利用不同的肿瘤模型对BFAR的抗肿瘤功能进行验证后发现,在小鼠皮下黑色素瘤模型和肺转移模型中,BFAR过表达的TH9细胞具有显著的抗肿瘤功效并可以增加PD-1抗体介导的免疫检查点治疗的敏感性。除此之外,该研究还使用了结直肠癌病人来源的肿瘤异种移植(PDX)模型,发现靶向BFAR基因进行改造的肿瘤病人来源的TH9细胞同样具有非常好的抗肿瘤效果。 综上所述,该研究证明,BFAR作为TGF-β调控的关键靶点,能够通过反馈作用精细调控TGFβ信号通路的激活和TH9细胞的分化,从而为增强TH9介导的肿瘤免疫疗法的治疗效果提供了新的策略。 郑重声明:本文版权归原作者所有,转载文章仅为传播更多信息之目的,如作者信息标记有误,请第一时间联系我们修改或删除。 | ||||||||||||||||||||||
|
上一篇:Science子刊:炎性小体通路在肿瘤放疗中作用重要
下一篇:STTT:首次揭示胃癌演进中mRNA乙酰化修饰新机制 |
||||||||||||||||||||||
| ||||||||||||||||||||||
 咨询热线:
咨询热线: