| Cell:递送内源性RNA的CAR-T细胞可改善对实体瘤的治疗 | ||||||||||||||||||||||
| [ 来源:转载自网络 发布日期:2021-09-09 09:42:43 责任编辑: 浏览次 ] | ||||||||||||||||||||||
|
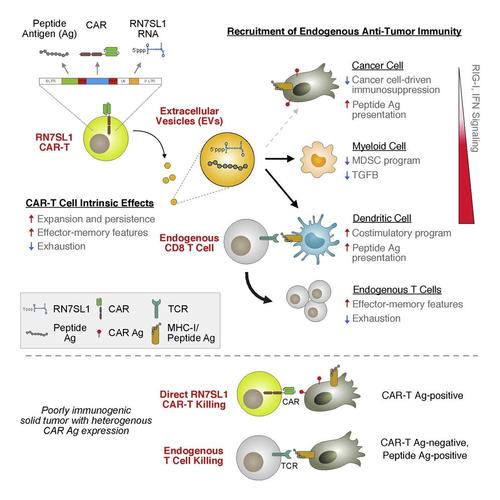
嵌合抗原受体(CAR)T细胞(CAR-T)疗法利用经过基因改造的T细胞来治疗某些类型的癌症,但是由于较差的肿瘤浸润、功能衰竭和抗原匮乏,CAR-T细胞在治疗实体瘤时经常遭遇挑战,它们的疗效受到限制。CAR-T细胞需要识别癌细胞上的特定靶标来杀死它们。然而,癌细胞并不总是携带特异性的靶标,或者它们找到了隐藏靶标的方法,从而免受CAR-T细胞的攻击。递送模式识别受体激动剂是提高免疫功能的一种策略,然而,将这些激动剂靶向到免疫细胞是具有挑战性的,而且在癌细胞中脱靶信号可能是有害的。 在一项新的研究中,来自美国宾夕法尼亚大学佩雷尔曼医学院的研究人员发现作为一种自然发生的激活RIG-I/MDA5信号的内源性RNA,RN7SL1可以激活身体自身的天然T细胞,以寻找逃避CAR-T细胞识别的癌细胞。这可能有助于改善治疗实体瘤的努力,毕竟实体瘤占人类癌症的大多数。相关研究结果于2021年8月30日在线发表在Cell期刊上,论文标题为“The immunostimulatory RNA RN7SL1 enables CAR-T cells to enhance autonomous and endogenous immune function”。
当由CAR-T细胞递送给肿瘤时,RN7SL1模拟了病毒RNA。RN7SL1被部署在CAR-T细胞释放的胞外囊泡中并选择性地转移到先天免疫细胞中,并激活RIG-I/MDA5信号。就像病毒感染后,作为身体免疫系统的一个分支,先天免疫细胞在看到CAR-T细胞递送的RN7SL1后被激活。这些先天免疫细胞如今可以刺激身体的T细胞,动员它们加入对癌症的攻击。然而,与CAR-T细胞一样,身体的天然T细胞也需要在癌细胞上找到一种靶标来识别和攻击。因此,CAR-T细胞提供的第二种工具是外来抗原,这些外来抗原被“涂抹”在癌细胞的表面,本质上标志着它们被天然的T细胞杀死。 这些作者利用小鼠模型表明,用这种一箭双雕的方式武装CAR-T细胞,招募身体自身的免疫系统,可以防止肿瘤复发,即使许多癌细胞不能被单独的CAR-T细胞识别和杀死。因此,对 CAR-T细胞进行基因改造,使之递送RN7SL1和外来抗原,可能有助于打击实体瘤逃避CAR-T细胞的常见方式,从而增强疗效。此外,与其他RNA激动剂不同,CAR-T细胞递送的RN7SL1限制了髓样抑制细胞(myeloid-derived suppressor cell, MDSC)的产生,减少了髓样细胞中的TGFB表达,并促进了具有共刺激功能的树突细胞(DC)亚群。 除了帮助招募身体的天然免疫系统外,这项新的研究发现,RN7SL1可以改善CAR-T细胞本身的功能。表达RN7SL1的CAR-T细胞有额外的优势,即持续时间更长,能更好地浸润肿瘤,更少地出现功能衰竭,并能保持更大的抗肿瘤功能。RN7SL1促进CAR-T细胞的扩增和效应记忆T细胞分化。 因此,内源性效应记忆T细胞和肿瘤特异性T细胞在数量上会扩大,从而也可杀死发生CAR识别的靶抗原丢失的实体瘤。在内源性免疫力提高的支持下,CAR-T细胞如今可以与RN7SL1一起共同部署外来的多肽抗原,以提高疗效,即使在异质性肿瘤缺乏足够的新抗原的情况下。 论文共同通讯作者、宾夕法尼亚大学佩雷尔曼医学院病理学与实验医学系免疫治疗教授、细胞免疫疗法中心主任、帕克癌症免疫疗法研究所主任Carl H. June博士说,“同时采用CAR-T细胞、增强内源性T细胞功能和对抗常见抑制机制的策略可能提供有效的组合方法来改善实体瘤反应。” 郑重声明:本文版权归原作者所有,转载文章仅为传播更多信息之目的,如作者信息标记有误,请第一时间联系我们修改或删除。 | ||||||||||||||||||||||
|
上一篇:Oncogene:识别出能将正常细胞转化为肝癌细胞的特殊因子
下一篇:Nat Commun:癌症疫苗或能有效克服癌细胞对疗法的耐受性 |
||||||||||||||||||||||
| ||||||||||||||||||||||
 咨询热线:
咨询热线: