| JCI:揭示KRAS突变激活CD47实现肿瘤免疫逃逸机制 | ||||||||||||||||||||||
| [ 来源:转载自网络 发布日期:2022-12-08 10:06:45 责任编辑: 浏览次 ] | ||||||||||||||||||||||
|
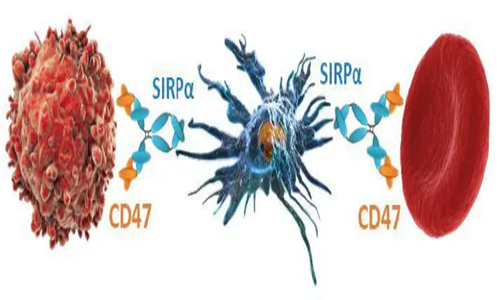
RAS(KRAS,NRAS和HRAS)是癌症中最常见的突变基因家族,约17%的实体瘤存在KRAS突变。KRAS突变是已知的三种最致命癌症——肺癌、结肠直肠癌和胰腺癌的重要驱动因素。然而,KRAS突变和肿瘤免疫逃逸的关系研究进展缓慢。近日,南京大学陈熹、闫超及南京医科大学尹荣联合课题组在 Journal of Clinical Investigation 期刊发表了题为:Oncogenic KRAS signaling drives evasion of innate immune surveillance in lung adenocarcinoma by activating CD47 的研究论文,该研究揭示了肺腺癌中KRAS突变通过激活CD47进而逃避先天免疫系统监视的新机制。
研究团队收集了肺腺癌患者的临床样本,分离出肿瘤细胞后和体外诱导的巨噬细胞进行共培养,发现KRAS突变病人的肿瘤细胞对巨噬细胞的吞噬不敏感;KRAS-G12C突变的H358细胞系也有同样现象。然后,研究团队使用了3种小鼠肺癌模型(H358原位植瘤和2种KRAS突变驱动的转基因小鼠原发肺癌模型),在体内水平检测了KRAS突变的肺癌细胞和巨噬细胞的互作情况,发现在肿瘤进展的早期巨噬细胞具备吞噬肿瘤细胞的能力,但随着肿瘤的进展,巨噬细胞的吞噬作用逐渐弱化甚至消失。以上实验在体外和体内验证了KRAS突变驱动的肿瘤天然免疫逃逸现象。 同时,研究团队还检测了肺腺癌患者临床样本中CD47的表达水平,发现CD47在KRAS突变肿瘤中的表达量相对KRAS野生型肿瘤更高。在KRAS驱动的肺癌小鼠模型中,敲降CD47可显著提高巨噬细胞对肿瘤细胞的吞噬,表明CD47是KRAS驱动肺癌细胞抗巨噬细胞吞噬作用的必要条件。 在探究KRAS突变上调CD47表达的分子机制的过程中,研究团队首先发现CD47存在由miR-34a介导的转录后调控现象,接下来验证了KRAS突变对miR-34a的负调控作用,随后通过一系列的分子生物学和药理学实验,该课题组证明突变的KRAS通过激活PI3K-STAT3信号从而抑制miR-34a的表达,进而缓解miR-34a对CD47的转录后抑制作用,最终导致CD47在肺腺癌细胞中出现异常的高表达。 最后,研究团队通过检测三个独立的肺腺癌样本阵列(约300例肺腺癌样本),证实KRAS突变状态与CD47表达呈正相关。同时,该课题组利用KRAS-G12C抑制剂AMG-510在体外和体内实验中对新发现的KRAS-CD47信号通路进行抑制,发现AMG-510可显著降低CD47的表达,并且增强巨噬细胞对肿瘤细胞的吞噬作用,最终恢复机体的先天免疫监控能力。 综上,该研究发现在肺腺癌中KRAS突变可驱动肿瘤细胞膜上CD47的高表达,抑制巨噬细胞对肿瘤细胞的吞噬作用,从而导致肿瘤的先天免疫逃逸,这一发现首次将KRAS突变和肿瘤的天然免疫逃逸联系起来,不仅揭示了KRAS突变驱动肿瘤发生发展的新机制,也为正在进行临床试验的CD47抗体药物提供了新的生物标志物,还为KRAS抑制剂和CD47抗体药物的联合用药提供了理论指导。 郑重声明:本文版权归原作者所有,转载文章仅为传播更多信息之目的,如作者信息标记有误,请第一时间联系我们修改或删除。 | ||||||||||||||||||||||
|
上一篇:Gastroenterology:饮食改变或能帮助克服结直肠癌的疗法耐受性
下一篇:Sci Transl Med:识别出预测黑色素瘤患者对免疫疗法耐受的特殊生物标志物 |
||||||||||||||||||||||
| ||||||||||||||||||||||
 咨询热线:
咨询热线: