巨噬细胞极化的分子机制及其在疾病中的意义
巨噬细胞是免疫系统中极为重要的一类“多面手”细胞。它们不仅能够吞噬细菌、病毒等外来病原体,还能清除体内衰老、死亡的细胞,并能在组织损伤后参与修复与再生过程。这一系列功能的实现,依赖于巨噬细胞出色的“适应能力”——即极化(polarization)。本篇文章,让我们一起来看下巨噬细胞极化的类型、分子机制及其在疾病中的作用。
什么是巨噬细胞极化?
巨噬细胞极化是指巨噬细胞在不同微环境信号的刺激下,分化为具有不同表型和功能的亚型。这种可塑性体现了免疫系统根据“战场环境”灵活部署的能力。
极化后的巨噬细胞表现出特定的表面分子表达模式、细胞因子分泌谱以及代谢通路调控。例如,在急性感染中,巨噬细胞倾向于极化为促炎型,以快速清除病原体;而在组织修复阶段,则极化为抗炎型,促进愈合与再生。
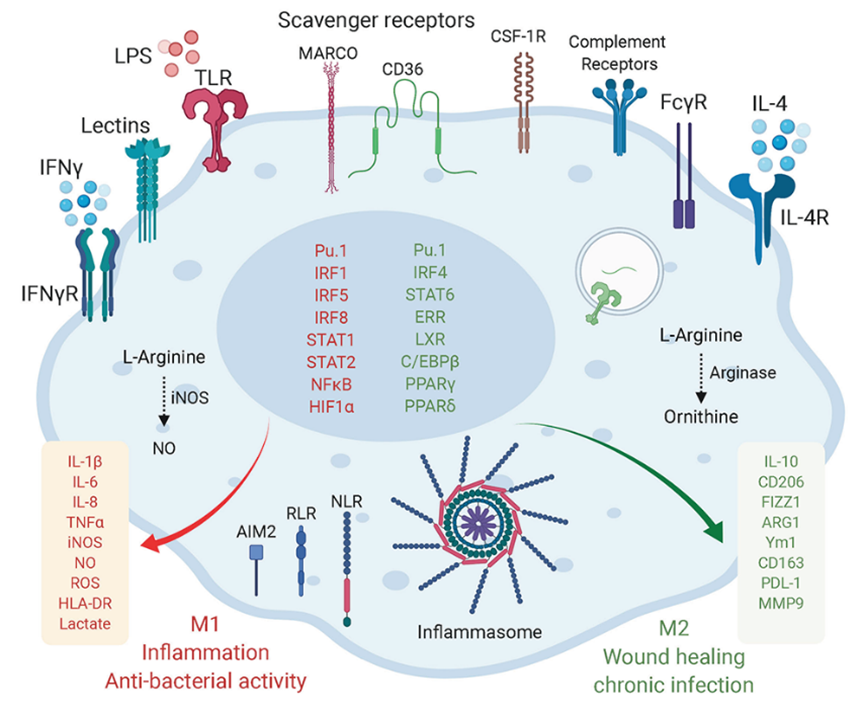
巨噬细胞极化至M1或M2的模型[1],图中显示了与M1和M2表型相关的主要巨噬细胞受体、转录因子和标志物。M1巨噬细胞的代谢转向糖酵解,而M2巨噬细胞的线粒体氧化磷酸化(OXPHOS)和脂质代谢增强。
M1/M2:巨噬细胞极化的经典分类
1. M1型(经典激活)
巨噬细胞首先处于M0状态,可在脂多糖(LPS)、干扰素-γ(IFN-γ)、肿瘤坏死因子-α(TNF-α)等刺激因子的诱导下极化为促炎的M1型巨噬细胞,分泌大量炎症因子,如IL-1β、IL-6、IL-12、TNF-α、一氧化氮(NO)以及活性氧(ROS)等[2]。
M1型巨噬细胞表达细胞表面标志CD40、CD80、CD86和MHC-IIR,并释放促炎分子,例如TNF-a、IL-1b、IL-6和iNOS。这些细胞具有强大的抗病原体、抗肿瘤和促炎作用[3]。
2. M2型(替代激活)
在白细胞介素-4(IL-4)、IL-13、IL-10等刺激下,巨噬细胞向M2型极化,可释放大量抗炎因子,如IL-10、转化生长因子β(TGF-β)、血管内皮生长因子(VEGF),并且几乎不产生IL-12等促炎因子[2]。
M2型巨噬细胞表达细胞表面标志CD163、CD204和CD206,主要参与抗炎反应、组织修复和免疫调节。
|
特征分类 |
M1型巨噬细胞(经典激活型) |
M2型巨噬细胞(替代激活型) |
|
表面分子 |
高表达CD80、CD86、MHC-II |
CD206(甘露糖受体)、CD163、Arginase-1 |
|
分泌因子 |
IL-1β、IL-6、TNF-α、IL-12、IL-23、NO、ROS |
IL-10、TGF-β、VEGF等 |
|
主要功能 |
清除病原体、激活T细胞、参与急性炎症 |
抑制炎症、促进伤口愈合、调节免疫反应 |
|
代谢特征 |
依赖糖酵解,快速供能支持炎症反应 |
依赖线粒体氧化磷酸化(OXPHOS)和脂质代谢 |
M2型巨噬细胞可进一步可分为四个亚型:M2a、M2b、M2c和M2d
M2a亚型由IL-4和IL-13诱导,分泌TGF-b、IGF和纤连蛋白等,它们可以促进伤口愈合和纤维化;
M2b亚型由免疫复合物或Toll样受体激动剂诱导,M2b巨噬细胞分泌IL-10,具有强大的免疫调节和抗炎作用;
M2c亚型由IL-10激活,分泌TGF-β和IL-10,发挥吞噬作用、免疫抑制、血管生成和组织纤维化的发展;
M2d亚型则在巨噬细胞集落刺激因子(M-CSF)、Toll样受体拮抗剂和IL-10等因子的作用下极化而成。M2d巨噬细胞分泌IL-10、TGF-β和VEGF,促进血管生成和癌症转移[3]。
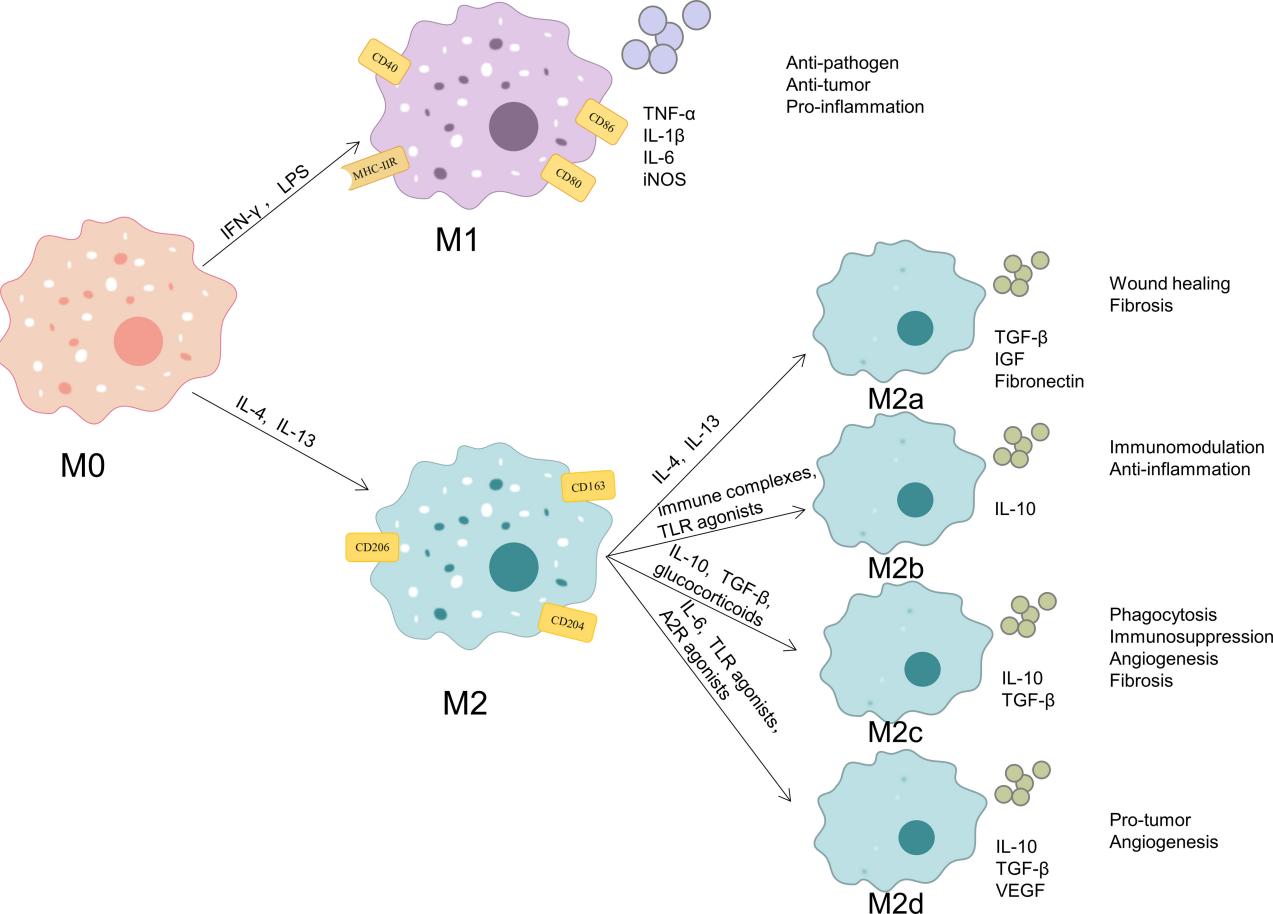
巨噬细胞极化的表型与功能。当暴露于不同的微环境刺激时,M0巨噬细胞可极化为M1巨噬细胞和M2巨噬细胞[3]。
巨噬细胞极化的分子机制
巨噬细胞极化由外源性刺激(如细胞因子、微生物产物)和内在信号(如代谢状态)共同驱动,涉及多个信号通路和转录因子:
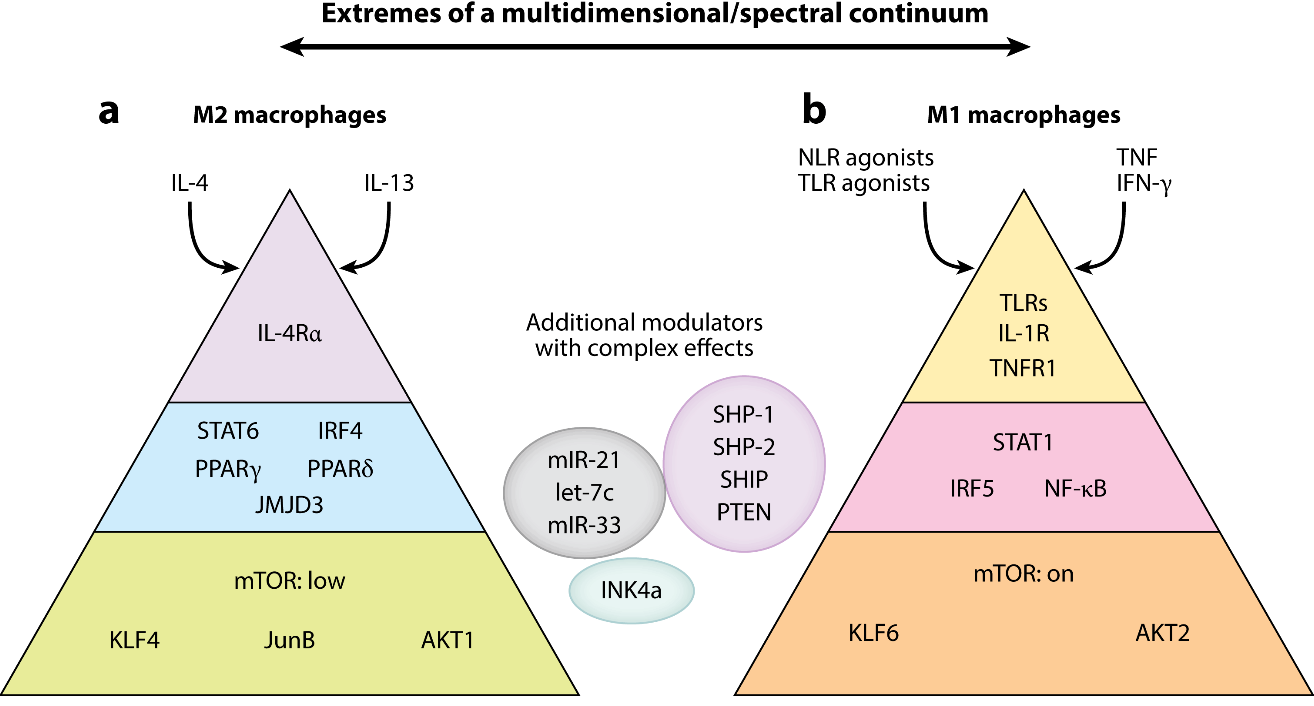
控制巨噬细胞极化的外在因素和内在因素[4]
主要信号通路包括:
STAT家族:STAT1促M1极化,STAT6促M2极化;
NF-κB通路:调控促炎反应,是M1极化的重要通路;
IRF(干扰素调节因子):IRF5促进M1,IRF4促进M2分化;
PPARγ:脂质代谢调节因子,推动M2表型;
HIF-1α:在缺氧条件下促进糖酵解,推动M1型代谢重编程。
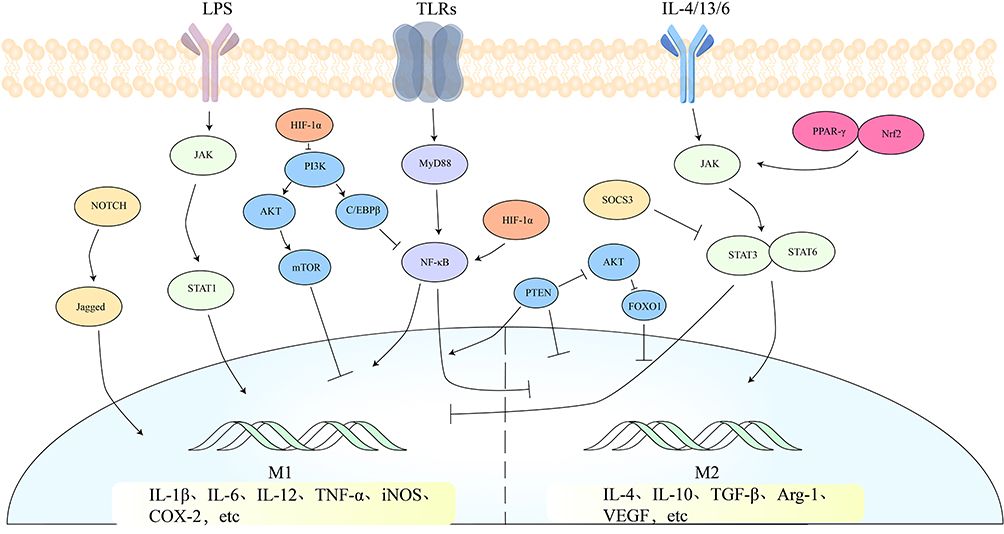
与巨噬细胞极化相关的主要有五条信号通路:JAK/STAT信号通路、TLRs/NF-κB信号通路、PI3K/AKT信号通路、Notch信号通路以及HIF-1信号通路。这些信号通路可单独或与其他通路协同作用,共同调控巨噬细胞的极化过程[2]。
此外,巨噬细胞的代谢状态(葡萄糖代谢、脂肪酸代谢、TCA循环)也直接影响其极化方向。例如:
M1型:TCA循环受抑,代谢中间产物(如琥珀酸)堆积,增强促炎活性;
M2型:维持完整的TCA循环,利用脂肪酸氧化,支持抗炎和组织修复功能。
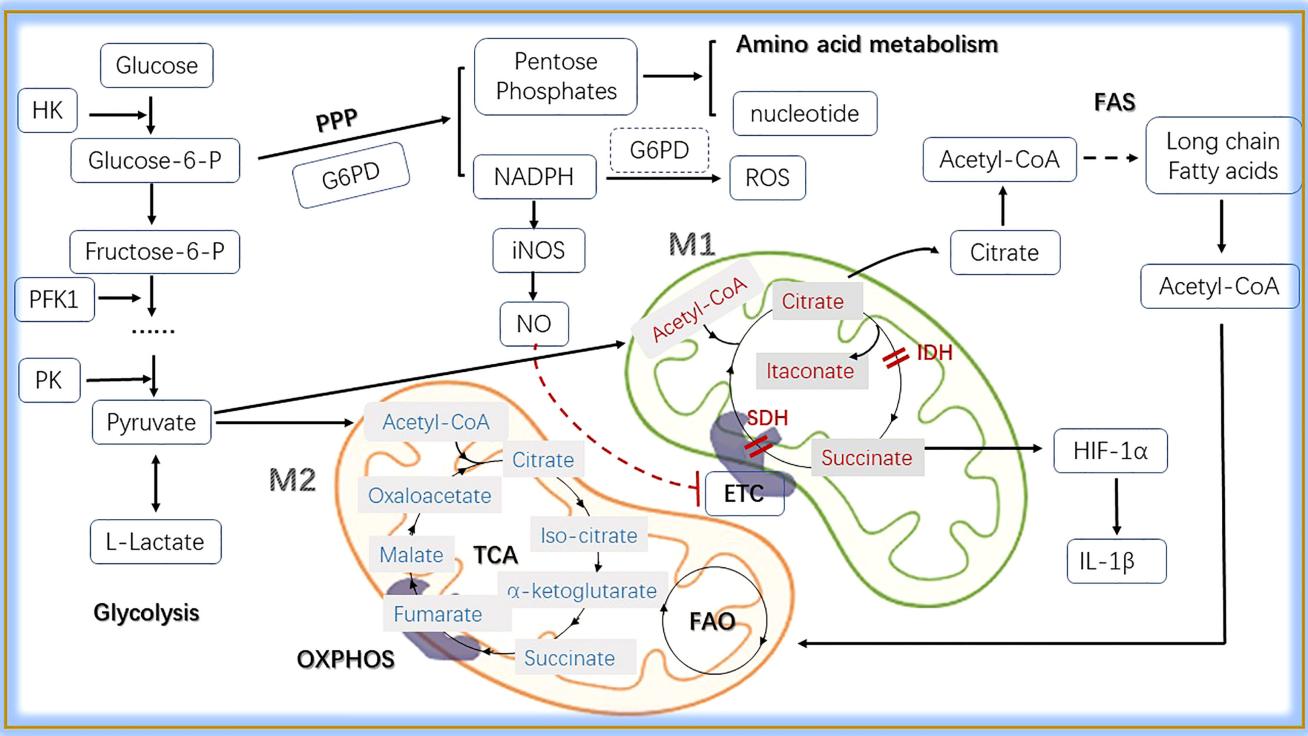
巨噬细胞中的主要代谢途径[5]
极化巨噬细胞在疾病中的角色
极化状态的巨噬细胞在多种疾病中扮演关键角色,例如:
1. 肿瘤
肿瘤相关巨噬细胞(TAMs)通常表现出M2样表型,分泌IL-10、TGF-β、VEGF等,促进肿瘤细胞生长、血管生成和免疫逃逸。靶向M2-TAM,或诱导其转化为M1型,是肿瘤免疫治疗的研究热点之一。
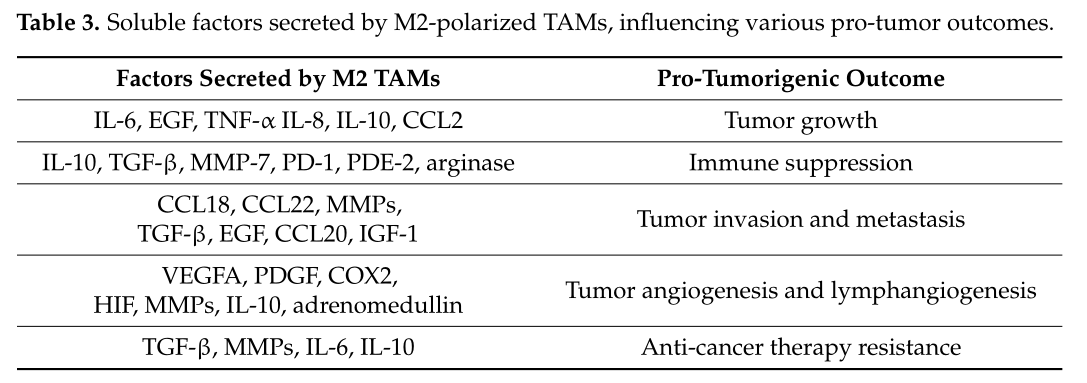
M2 极化 TAM 分泌的可溶性因子,影响各种促肿瘤结果[6]
2. 感染性疾病
在感染早期,M1型巨噬细胞通过释放NO和炎症因子有效清除病原体;而在慢性感染或恢复期,M2型则有助于控制炎症并促进组织修复,防止过度免疫损伤。
3. 自身免疫疾病
如类风湿性关节炎、系统性红斑狼疮等疾病中,M1型巨噬细胞过度活跃会加剧炎症和组织破坏。恢复M1/M2平衡可能是潜在的治疗策略。
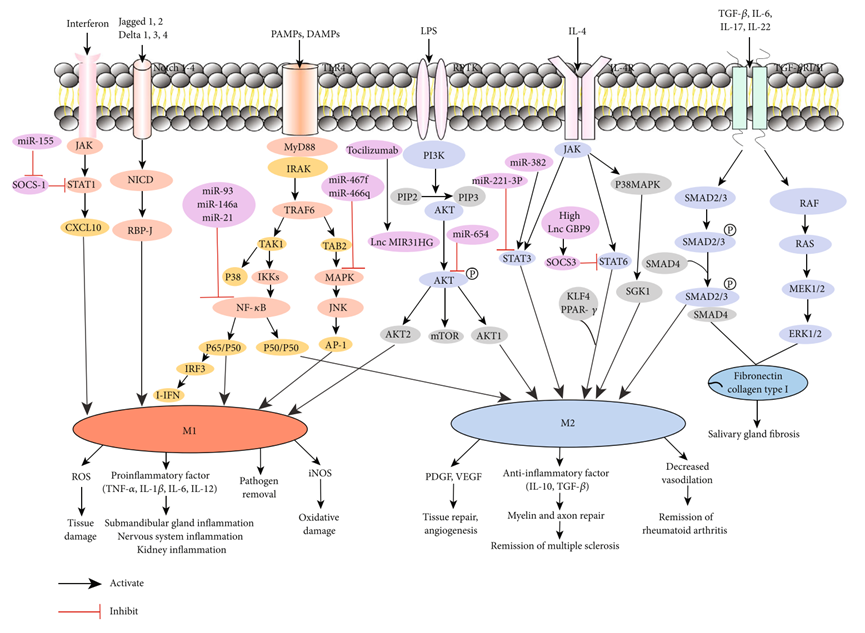
巨噬细胞极化相关信号通路与自身免疫性疾病之间关系[7]
4. 代谢相关疾病
在肥胖、2型糖尿病等代谢性疾病中,脂肪组织中巨噬细胞由M2型向M1型转化,产生慢性低度炎症,促进胰岛素抵抗和代谢紊乱的发展。
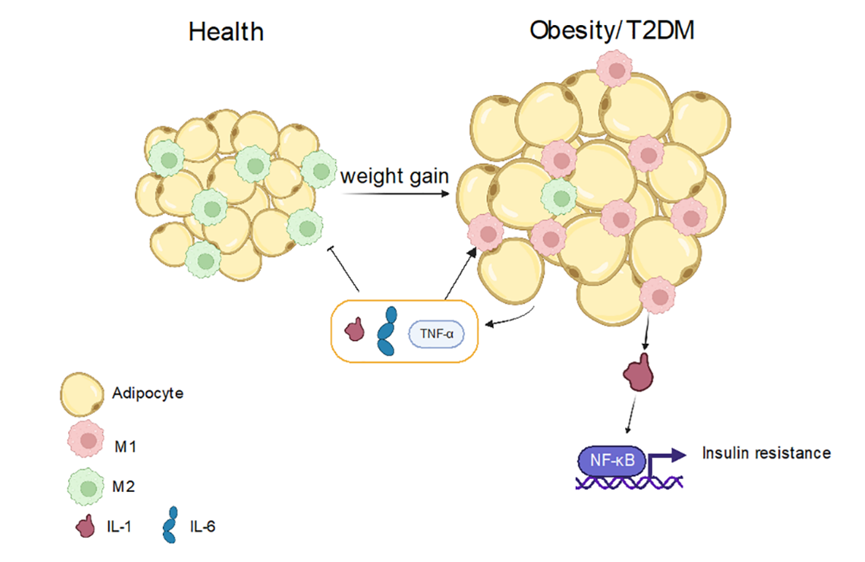
巨噬细胞极化在肥胖和2型糖尿病(T2DM)中的作用[8]
在正常人体内,脂肪细胞体积较小,主要存在的是M2型样巨噬细胞。当体重增加时,脂肪细胞的体积也随之增大,此时主要是M1型样巨噬细胞占主导地位。炎症状态下会分泌IL-1、IL-6等物质,进一步促进M1型样巨噬细胞的生成,同时抑制M2型样巨噬细胞。此外,还会产生IL-1β,激活NF-κB信号通路,导致胰岛素抵抗,从而进一步促进肥胖或2型糖尿病的发展[8]。
总结
巨噬细胞极化展示了其对环境信号的高度感应性和功能多样性。从病原清除到组织修复,从抗炎免疫调节到参与肿瘤进展,巨噬细胞在人体健康与疾病中起着关键作用。未来,深入理解其极化机制,将为多种疾病的诊疗提供新思路。
参考文献:
[1] Galli G, Saleh M. Immunometabolism of Macrophages in Bacterial Infections. Front Cell Infect Microbiol. 2021 Jan 29;10:607650.
[2] Hu K, et al. Macrophage Polarization and the Regulation of Bone Immunity in Bone Homeostasis. J Inflamm Res. 2023 Aug 22;16:3563-3580.
[3] Xia T, et al. Advances in the role of STAT3 in macrophage polarization. Front Immunol. 2023 Apr 4;14:1160719.
[4] Murray PJ. Macrophage Polarization. Annu Rev Physiol. 2017 Feb 10;79:541-566.
[5] Sun JX, Xu XH, Jin L. Effects of Metabolism on Macrophage Polarization Under Different Disease Backgrounds. Front Immunol. 2022 Jul 14;13:880286.
[6] Boutilier AJ, Elsawa SF. Macrophage Polarization States in the Tumor Microenvironment. Int J Mol Sci. 2021 Jun 29;22(13):6995.
[7] Peng Y, et al. Regulatory Mechanism of M1/M2 Macrophage Polarization in the Development of Autoimmune Diseases. Mediators Inflamm. 2023 Jun 8;2023:8821610.
[8] Luo M, et al. Macrophage polarization: an important role in inflammatory diseases. Front Immunol. 2024 Apr 10;15:1352946.
来源于【科研综述】

声明:本文仅用于分享,如涉及版权等问题,请尽快联系我们,我们第一时间更正,谢谢!


