胶质母细胞瘤侵袭机制新发现!Nature Cancer揭示神经胶质细胞如何引导肿瘤扩散
胶质母细胞瘤(GBM)是最致命的脑癌之一,其可怕之处在于癌细胞能像"幽灵"一样穿透正常脑组织,形成难以切除的微小转移灶。即使经过手术、放疗和化疗等综合治疗,患者平均生存期仍不足15个月。
近年来,科学家发现肿瘤微环境中的免疫细胞可能是助纣为虐的"帮凶",尤其是小胶质细胞和巨噬细胞组成的TAM群体,占肿瘤细胞总数的50%。
2025年发表于《Nature Cancer》的研究"Glioblastoma shift from bulk to infiltrative growth is guided by plexin-B2-mediated microglia alignment in invasive niches"首次揭示:这些免疫细胞会形成特殊的"肿瘤通道",引导癌细胞从团块状生长转变为浸润性扩散。
这一发现为阻止肿瘤扩散提供了全新靶点,有望改写胶质母细胞瘤的治疗格局。

1、研究背景
胶质母细胞瘤的致命性主要源于其两大特性:不受控制的增殖和弥漫性浸润。
虽然癌细胞自身的运动机制已被广泛研究,但肿瘤微环境如何调控这种侵袭模式的转换仍迷雾重重。
大脑组织质地柔软,富含蛋白聚糖而缺乏胶原蛋白等结构蛋白,理论上不利于癌细胞迁移——就像在棉花糖里穿行远比在钢筋森林中跋涉更困难。
但胶质母细胞瘤却能在这种环境中开辟道路,甚至形成有组织的集体迁移轨迹。
肿瘤相关小胶质细胞和巨噬细胞(TAM)被怀疑是幕后推手。这些细胞原本是大脑的"清道夫",负责清除病原体和受损细胞,但在肿瘤环境中会"叛变"。
研究发现,TAM能分泌细胞因子、重塑细胞外基质,帮助癌细胞生存和扩散。
更引人深思的是,修复神经损伤的机制可能被肿瘤盗用——研究团队此前发现,一种名为plexin-B2的蛋白能在神经损伤后引导小胶质细胞形成再生通道,这会不会也是肿瘤侵袭的"钥匙"?
2、研究结果
01 TAM形成"肿瘤通道"引导癌细胞迁移
研究团队利用KR158小鼠胶质母细胞瘤模型(一种高度浸润的免疫competent模型),追踪到了令人惊讶的现象:在癌细胞侵袭前沿,小胶质细胞会提前动员,形成广泛的"肿瘤前场"(oncofields)。
当癌细胞开始浸润时,这些免疫细胞先形成"神经胶质网"包裹小簇癌细胞,随后转变为长条状的"肿瘤流"(oncostreams),与癌细胞交织排列,共同向周围脑组织推进(图1a-g)。
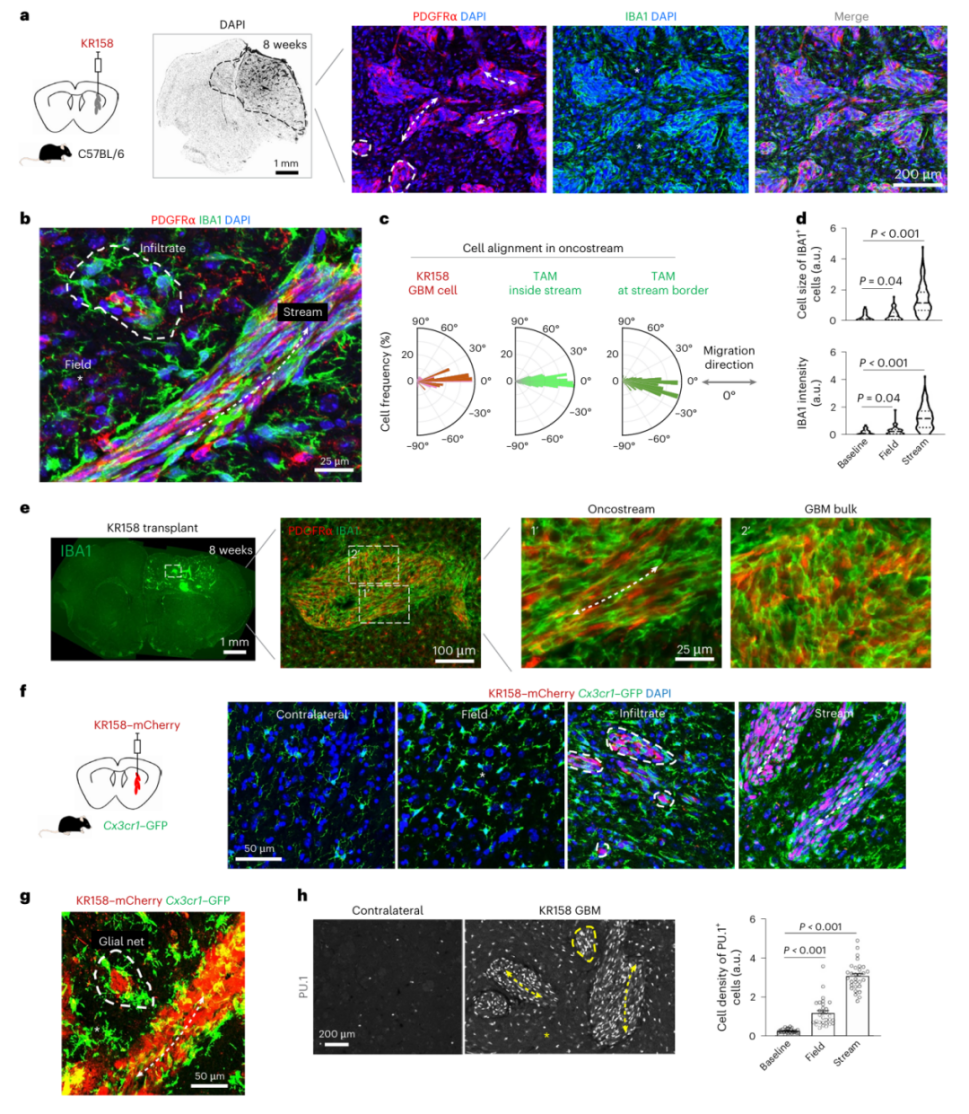
图1 不同胶质母细胞瘤侵袭微环境中 TAM 的动员与空间组织
这些通道并非沿着血管或神经纤维等预先存在的结构形成,而是癌细胞和TAM共同搭建的全新路径。
通过对细胞orientation的量化分析发现,通道内的癌细胞和TAM都沿着迁移轴定向排列,角度偏差不超过10°,而肿瘤团块中的细胞则呈随机分布(图1c,e)。
更关键的是,这种结构在人类胶质母细胞瘤样本中同样存在——患者肿瘤边缘的TAM也表现出从星形到梭形的形态转变,在侵袭通道中呈纵向排列(图2a-c)。
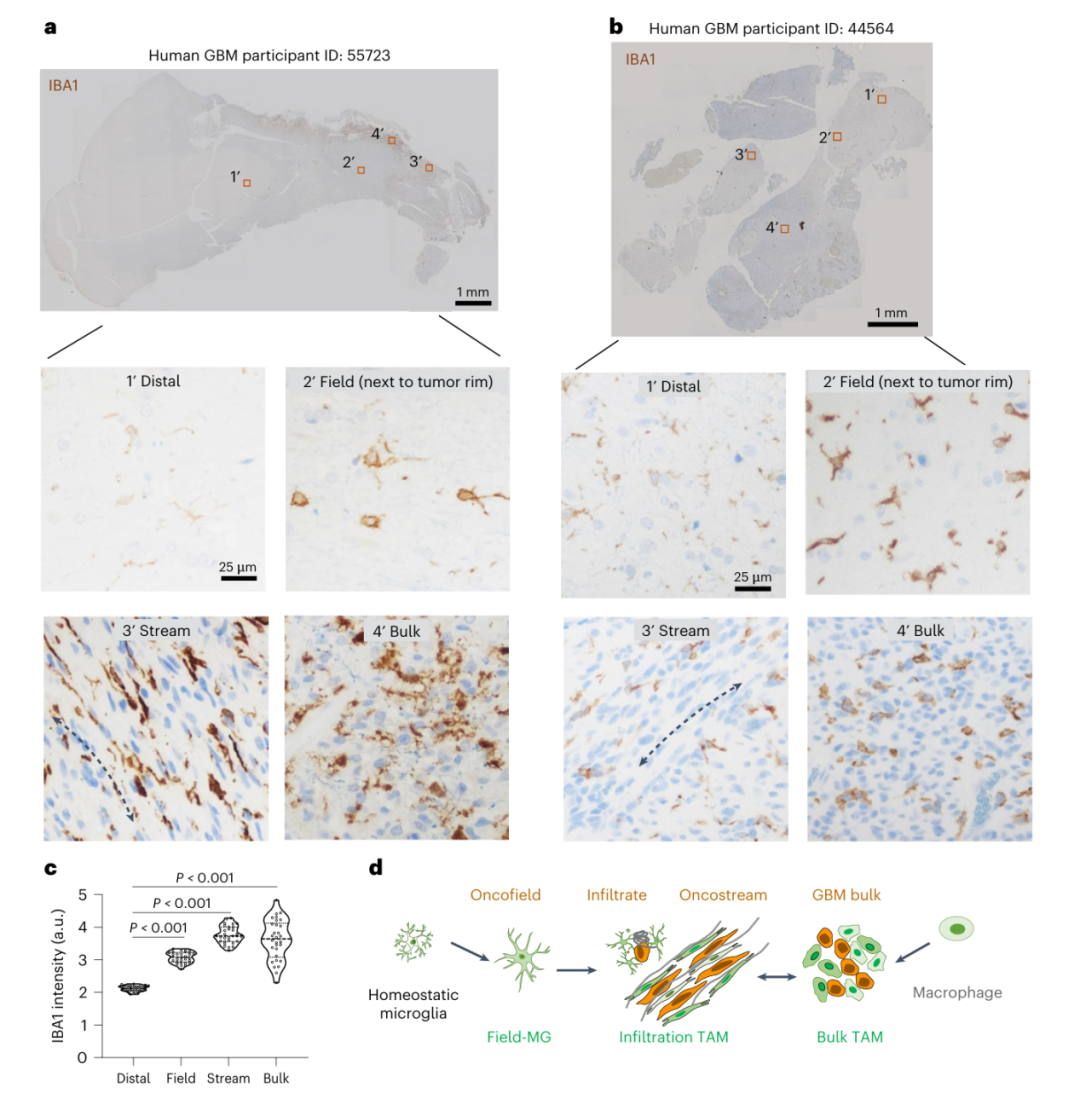
图2 人类胶质母细胞瘤样本侵袭性微环境中的 TAM 激活
02不同微环境中的细胞呈现独特分子特征
单细胞RNA测序揭示了更精细的图景:肿瘤细胞和TAM都存在三种不同状态,分别对应侵袭前沿和肿瘤团块(图3a-d)。
在侵袭前沿的"肿瘤前场",小胶质细胞高表达与轴突延伸、细胞黏附相关的基因;在侵袭通道中,细胞则激活了细胞运动、细胞外基质分解相关通路;而在肿瘤团块中,TAM主要表现出炎症和缺氧相关特征(图3c,d)。
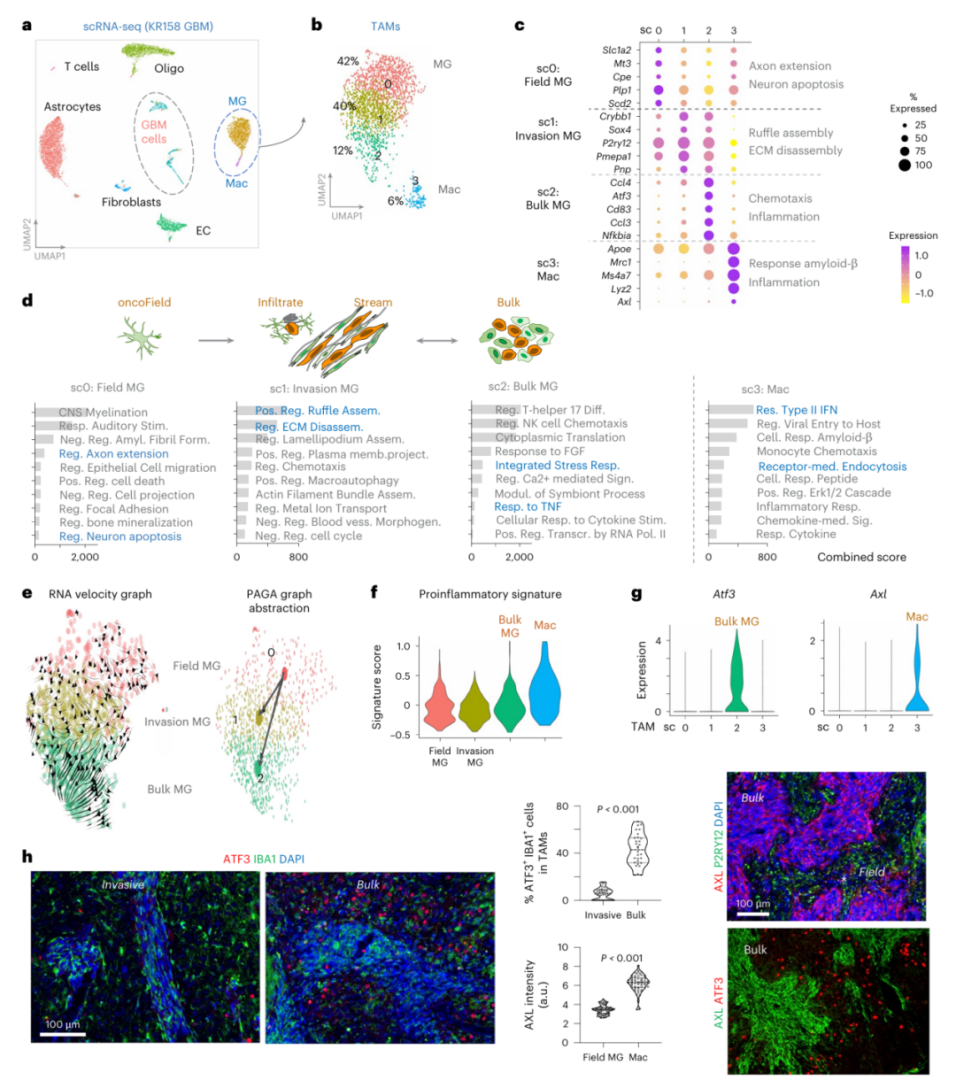
图3 KR158 胶质母细胞瘤单细胞测序揭示与侵袭性微环境和肿瘤团块对应的不同 TAM 亚群
肿瘤细胞也呈现类似分区:侵袭通道中的细胞高表达与收缩、离子运输相关的基因(如Fxyd1),而团块中的细胞则活跃表达干细胞增殖相关基因(如Hmgb2)(图4a,f,g)。
这些发现得到人类样本验证——在胶质母细胞瘤空间转录组数据中,团块特征基因在肿瘤核心富集,而侵袭特征基因在边缘区域高表达(图4h)。
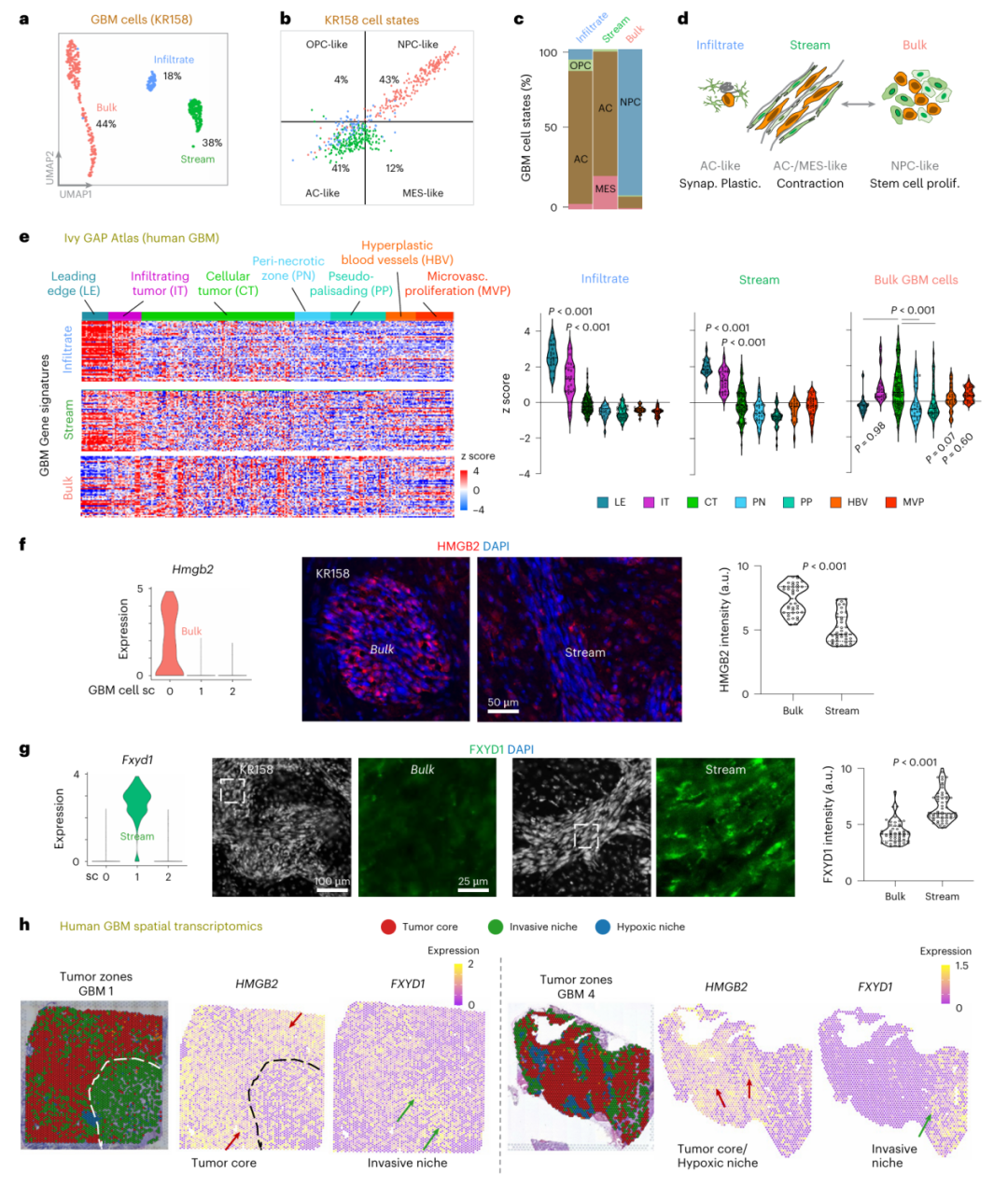
图4 单细胞测序揭示与侵袭性微环境和肿瘤团块对应的不同肿瘤细胞亚群
03 Plexin-B2是转换侵袭模式的"开关"
通过构建plexin-B2基因敲除小鼠,研究团队证实了这种蛋白的关键作用。
当TAM缺乏plexin-B2时,肿瘤生长模式发生戏剧性转变:原本的浸润性生长变成团块状扩张,侵袭距离减少40%,通道数量减少60%(图6b,c)。
细胞排列的有序性被彻底打破,TAM和癌细胞都失去定向性(图6d,e),细胞外基质的排列也变得紊乱——纤维连接蛋白和胶原蛋白不再形成纵向纤维(图6f)。
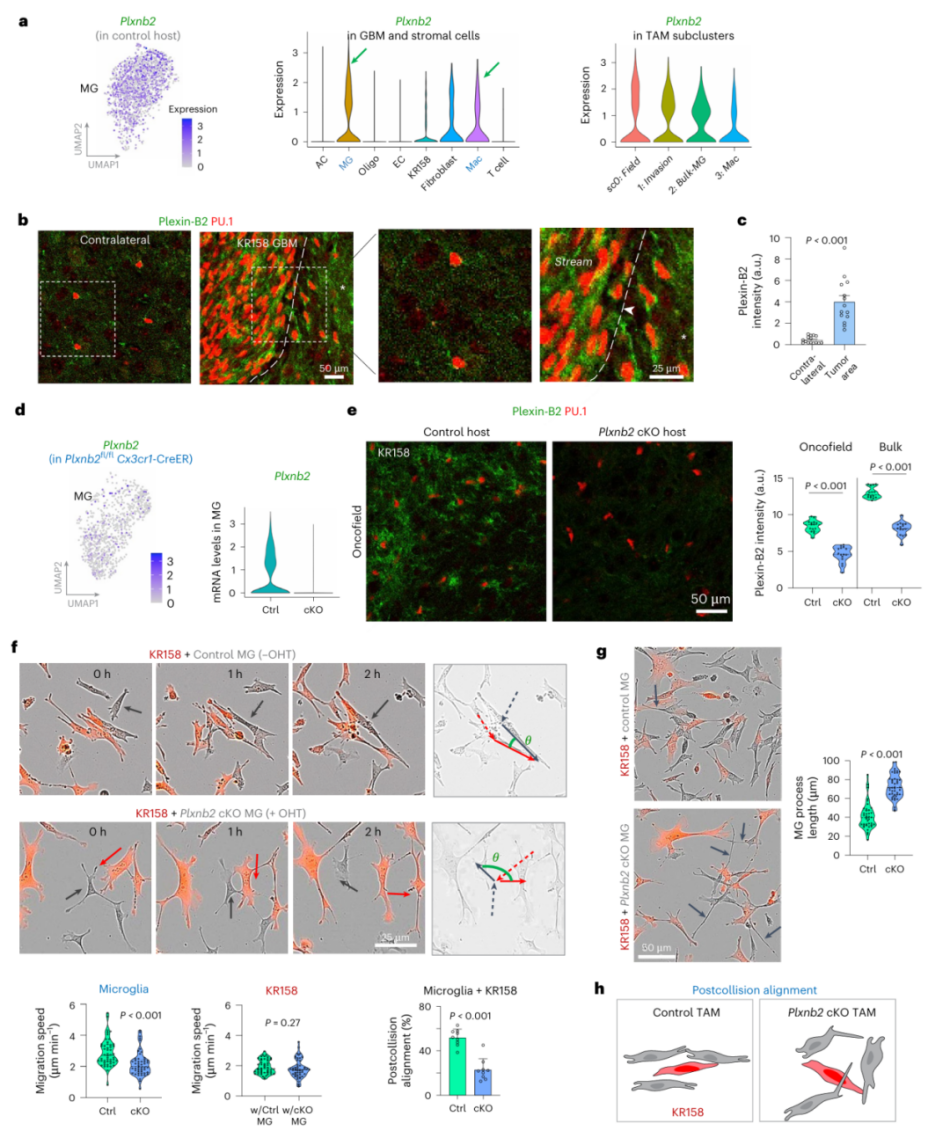
图5 TAM 中 plexin-B2 的诱导促进碰撞后对齐
分子机制研究发现,plexin-B2通过调控细胞碰撞后的alignment发挥作用。
活细胞成像显示,正常TAM在与癌细胞碰撞后能迅速调整方向,保持迁移一致性;而敲除plexin-B2的TAM则会"迷路",碰撞后方向紊乱(图5f,h)。
这种功能缺陷源于细胞骨架动态的异常——敲除细胞的突起更长且僵硬,难以适应迁移需求(图5g)。
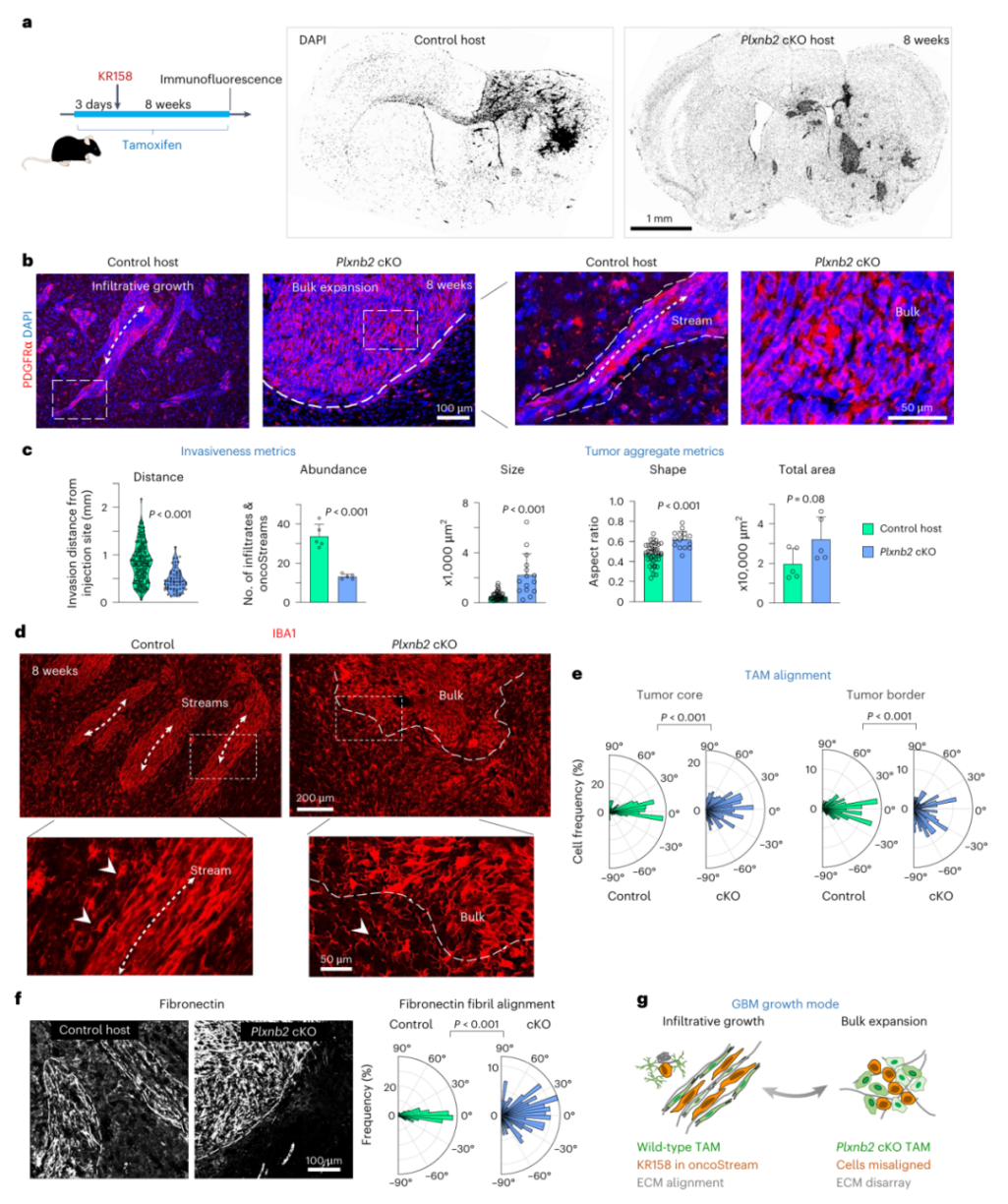
图6 TAM 通过 plexin-B2 介导的对齐促进胶质母细胞瘤侵袭
04 MDK-miR-124轴调控plexin-B2的表达
那么,癌细胞如何"命令"TAM表达plexin-B2?研究发现这是一种间接调控:癌细胞分泌的中期因子(MDK)会抑制小胶质细胞中的miR-124,而miR-124原本会结合plexin-B2的mRNA并抑制其翻译(图7c,d)。
当miR-124被抑制,plexin-B2蛋白水平就会上升(图7a,e)。实验证实,用MDK处理小胶质细胞能显著上调plexin-B2,而敲除癌细胞的MDK基因则会削弱这种诱导作用(图7i,j)。
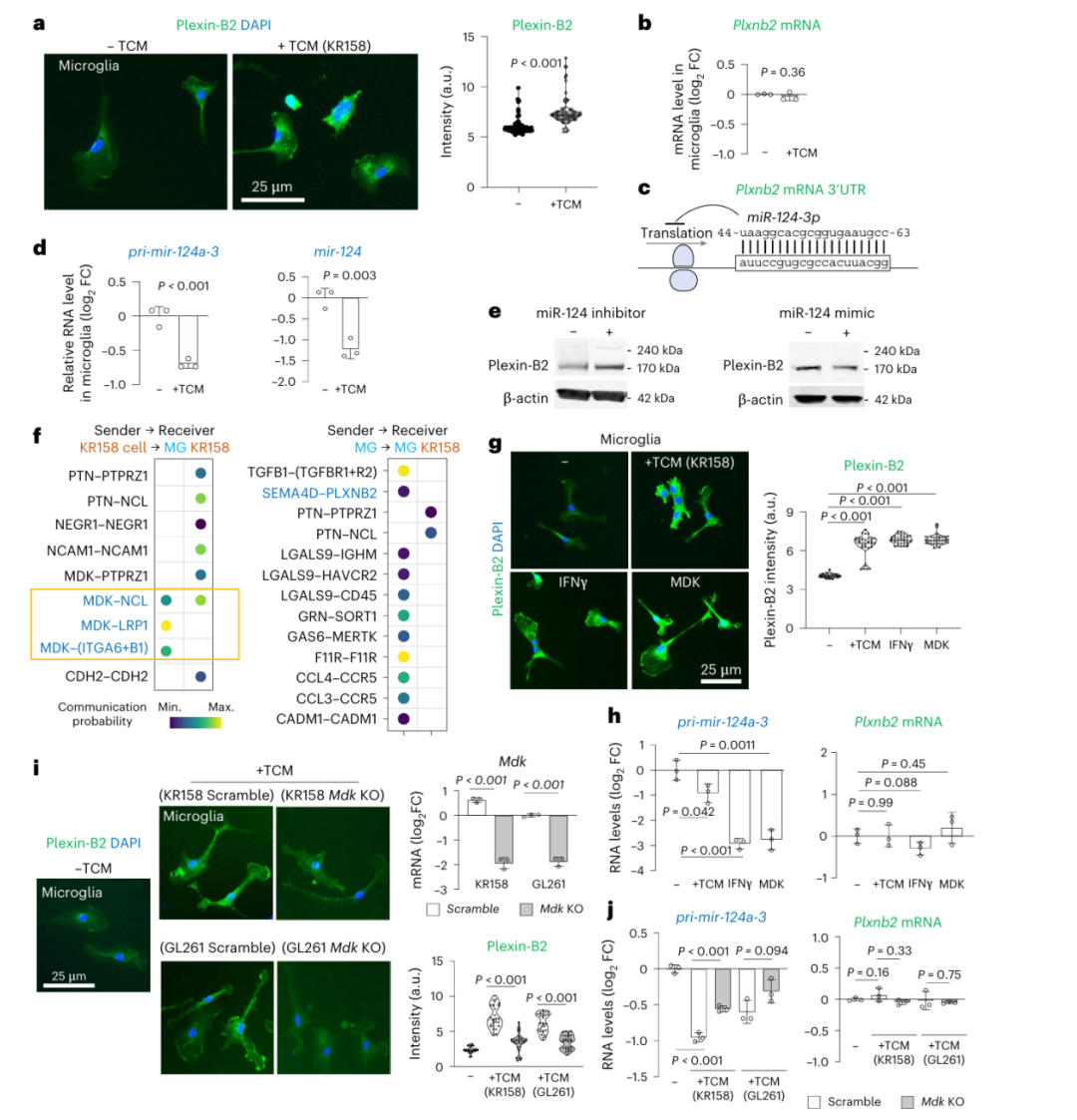
图7 Plexin-B2 的诱导由 miR-124 介导
3、研究亮点与不足
本研究的突破性在于首次完整描绘了TAM介导的肿瘤侵袭通道形成过程,揭示了plexin-B2作为"侵袭模式转换器"的核心作用。
三个关键发现尤为重要:一是发现TAM在癌细胞到达前就已动员并构建"前沿阵地";二是证实细胞外基质的有序排列是这种侵袭模式的关键特征而非结果;三是通过基因敲除实验确凿证明了plexin-B2对侵袭模式转换的决定性作用。
但研究仍存在局限:首先,虽然在两种小鼠模型(KR158和GL261)中得到一致结果,但人类肿瘤的复杂性可能更高——患者TAM中MG和巨噬细胞的比例差异较大,可能影响治疗响应。
其次,敲除plexin-B2虽然减少了侵袭,但肿瘤团块增大反而缩短了小鼠生存期,这提示单独阻断侵袭可能需要与抑制增殖的疗法联合使用。
最后,MDK只是调控plexin-B2的众多因素之一,其他信号通路的作用仍有待探索。
4、研究意义与展望
这项研究为胶质母细胞瘤治疗开辟了三个全新方向:
一是靶向plexin-B2的药物可能阻断肿瘤通道形成,将癌细胞"困"在团块中,便于手术切除;
二是抑制MDK或恢复miR-124表达可间接降低plexin-B2水平,避免直接干预可能带来的神经损伤风险;
三是可以设计双靶点疗法——既阻止侵袭又抑制增殖,解决单一靶点可能导致的肿瘤负荷增加问题。
临床转化前景令人期待。研究发现人类胶质母细胞瘤中plexin-B2的表达模式与小鼠模型一致,且其水平与侵袭程度正相关。
这意味着基于该靶点的疗法可能对患者有效。更精妙的是,由于plexin-B2在正常脑组织中主要在损伤修复时短暂表达,针对性抑制可能减少副作用。
未来研究需要解决的关键问题包括:如何特异性靶向肿瘤微环境中的TAM而不影响正常小胶质细胞功能?
联合疗法的最佳配比是什么?此外,这种侵袭模式是否存在于其他类型肿瘤中?无论如何,这项研究改变了我们对肿瘤微环境的认知——它不仅是肿瘤生长的"土壤",更是决定其扩散方式的"指挥系统"。
参考文献:
Kang S, et al. Glioblastoma shift from bulk to infiltrative growth is guided by plexin-B2-mediated microglia alignment in invasive niches. Nat Cancer. 2025 May 29:10.1038/s43018-025-00985-4.
https://www.nature.com/articles/s43018-025-00985-4
来源于【圣荷科技】
声明:本文仅用于分享,如涉及版权等问题,请尽快联系我们,我们第一时间更正,谢谢!


